Iodo

O iodo (do grego iodés, cor violeta) é um elemento químico de símbolo I , de número atómico 53 (53 prótons e 53 elétrons) e de massa atómica 126,9 u. À temperatura ambiente, o iodo encontra-se no estado sólido.
É um não metal, do grupo dos halogênios (17 ou 7A) da classificação periódica dos elementos. É o menos reativo e o menos eletronegativo de todos os elementos do seu grupo.
É um oligoelemento, empregado principalmente na medicina, fotografia e como corante.
É um não metal, do grupo dos halogênios (17 ou 7A) da classificação periódica dos elementos. É o menos reativo e o menos eletronegativo de todos os elementos do seu grupo.
É um oligoelemento, empregado principalmente na medicina, fotografia e como corante.
Tabela completa
Nome, símbolo, número
Iodo, I, 53
Classe , série química
Não-metal, representativo
( Halogênio )
Grupo, período, bloco
17 ( VIIA ), 5 , p
Densidade
4940 kg/m³
Cor , Aparência
negro
Nome, símbolo, número
Iodo, I, 53
Classe , série química
Não-metal, representativo
( Halogênio )
Grupo, período, bloco
17 ( VIIA ), 5 , p
Densidade
4940 kg/m³
Cor , Aparência
negro

volume atómico
25.70 cm³/mol
Raio atômico
115 pm
Raio covalente 133 pm
Estado da matéria Sólido (não magnético)
Ponto de fusão 386,85 K (113,7 °C)
Ponto de ebulição 457,6 K (184,4 °C)
1º Potencial de ionização
1008,4 kJ/mol
Raio atômico
115 pm
Raio covalente 133 pm
Estado da matéria Sólido (não magnético)
Ponto de fusão 386,85 K (113,7 °C)
Ponto de ebulição 457,6 K (184,4 °C)
1º Potencial de ionização
1008,4 kJ/mol
Descobridor
 O iodo foi descoberto em Maio de 1811, pelo químico francês, Bernard Courtois, que estava encarregado de produzir nitrato de potássio para os exércitos de Napoleão. O processo de Courtois consistia na conversão de nitrato de cálcio, oriundo de depósitos de salitre, em nitrato de potássio, por intermédio da potassa. Esta era obtida a partir das cinzas de algas marinhas. Courtois verificou que quando lavava essas cinzas com ácido sulfúrico, para extrair certas impurezas, surgia um leve fumo que se condensava nos instrumentos de cobre, corroendo-os. Posteriormente observou a formação de um precipitado, que ao ser aquecido dava origem a um vapor de cor violeta. As propriedades desta nova substância foram primeiro investigadas por F. Clement e J. B. Desormes e posteriormente por Gay-Lussac, que a identificou como um novo elemento. Gay-Lussac chamou-lhe iodo, que deriva da palavra grega para violeta.
O iodo foi descoberto em Maio de 1811, pelo químico francês, Bernard Courtois, que estava encarregado de produzir nitrato de potássio para os exércitos de Napoleão. O processo de Courtois consistia na conversão de nitrato de cálcio, oriundo de depósitos de salitre, em nitrato de potássio, por intermédio da potassa. Esta era obtida a partir das cinzas de algas marinhas. Courtois verificou que quando lavava essas cinzas com ácido sulfúrico, para extrair certas impurezas, surgia um leve fumo que se condensava nos instrumentos de cobre, corroendo-os. Posteriormente observou a formação de um precipitado, que ao ser aquecido dava origem a um vapor de cor violeta. As propriedades desta nova substância foram primeiro investigadas por F. Clement e J. B. Desormes e posteriormente por Gay-Lussac, que a identificou como um novo elemento. Gay-Lussac chamou-lhe iodo, que deriva da palavra grega para violeta.Desde a sua descoberta que o iodo tem vindo a contribuir para o desenvolvimento da tecnologia química. Destacam-se as pesquisas de Hofmann em química orgânica sintética, bem como as de Williamson, Wurtz e Grignard, em meados no século XIX.
Ocorrência
O iodo está largamente distribuído pela Natureza, embora nunca se encontre livre, ocorrendo principalmente na forma de iodetos e iodatos. É comum encontrar vestígios de iodo em rochas, nos solos e em depósitos de salmoura. A água do mar contém cerca de 0,05 ppm de iodo. Existem muito poucos minerais em que este elemento seja o constituinte principal. Contudo, os mais importantes são a lautarite e o iodato de cálcio, que se encontram nos depósitos de nitratos do Chile.
Também se encontra iodo como constituinte de alguns seres vivos, de plantas e de algas marinhas, embora em pequenas percentagens.
O iodo está largamente distribuído pela Natureza, embora nunca se encontre livre, ocorrendo principalmente na forma de iodetos e iodatos. É comum encontrar vestígios de iodo em rochas, nos solos e em depósitos de salmoura. A água do mar contém cerca de 0,05 ppm de iodo. Existem muito poucos minerais em que este elemento seja o constituinte principal. Contudo, os mais importantes são a lautarite e o iodato de cálcio, que se encontram nos depósitos de nitratos do Chile.
Também se encontra iodo como constituinte de alguns seres vivos, de plantas e de algas marinhas, embora em pequenas percentagens.
Aplicações
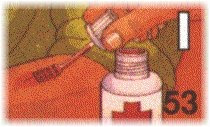
O iodeto de potássio, KI, é adicionado ao sal comum, NaCl (mistura denominada de sal iodado), para prevenir o surgimento do bócio endêmico, doença causada pelo déficit de iodo na dieta alimentar.
A tintura de iodo é uma solução de iodo e KI em álcool, em água ou numa mistura de ambos (por exemplo, 2 gramas de iodo e 2,4 gramas de KI em 100 mL de etanol), que tem propriedades anti-ssépticas. É empregada como desinfetante da pele ou para a limpeza de ferimentos. Também pode ser usada para a desinfectar a água.
Os compostos de iodo são importantes no campo da química orgânica e são muito úteis na medicina; iodetos, assim como a tiroxina, que contém iodo, são utilizados em medicina interna.
O iodeto de potássio, KI, é empregado em fotografia.
Se utiliza iodo em lâmpadas de filamento de tungstênio (wolfrâmio) para aumentar a sua vida útil.
O triiodeto de nitrogênio, NI3, é um explosivo de impacto, demasiadamente instável para a comercialização, porém pode-se facilmente prepará-lo de forma caseira.
Os isótopos radioativos Iodo-123 e Iodo-131 são utilizados em medicina nuclear, para estudar a Glândula Tiróide. O Iodo-131 é usado também na terapia de alguns tipos de cancro da Tiróide, graças ao seu decaimento com produção de particula beta.
Ação Biológica
A descoberta de iodo em algas marinhas, por Coustois em 1811, constitui a primeira referência à presença do elemento em organismos vivos. A quantidade de iodo presente nas plantas não ultrapassa as 100 mg por 100 g de matéria seca da planta. No entanto, esta razão é 10 000 vezes maior para as algas marinhas.
O estudo da influência do iodo no metabolismo animal tornou-se bastante importante a partir de 1895, quando se descobriu que o elemento é um constituinte normal da tiróide. Cedo se verificou que uma dieta deficiente em iodo era a causa principal do bócio. Em zonas onde o bócio é muito frequente, é custome adicionar uma pequena fracção de NaI ou KI a 100 000 partes de sal das cozinhas para combater esta deficiência.
O isótopo I 131, com um período de oito dias, tem-se revelado muito útil como indicador radioactivo, em particular no estudo e terapêutica do cancro da tiróide.
A descoberta de iodo em algas marinhas, por Coustois em 1811, constitui a primeira referência à presença do elemento em organismos vivos. A quantidade de iodo presente nas plantas não ultrapassa as 100 mg por 100 g de matéria seca da planta. No entanto, esta razão é 10 000 vezes maior para as algas marinhas.
O estudo da influência do iodo no metabolismo animal tornou-se bastante importante a partir de 1895, quando se descobriu que o elemento é um constituinte normal da tiróide. Cedo se verificou que uma dieta deficiente em iodo era a causa principal do bócio. Em zonas onde o bócio é muito frequente, é custome adicionar uma pequena fracção de NaI ou KI a 100 000 partes de sal das cozinhas para combater esta deficiência.
O isótopo I 131, com um período de oito dias, tem-se revelado muito útil como indicador radioactivo, em particular no estudo e terapêutica do cancro da tiróide.